Resistenz-Striptease und periplasmatische Küsse: Wie Bakterien mit Giftstoffen fertig werden
Bakterielle Infektionskrankheiten sind im heutigen Europa (noch?) kein Problem mehr. Die Arbeit der Mikrobiologen in den letzten beiden Jahrhunderten hat uns mit Hygiene-Vorschriften, Massen-Impfungen und den Antibiotika drei mächtige Säulen beschert, mit denen wir erfolgreich pathogene Bakterien in ihre Schranken weisen können. Durch natürliche Evolution, leider beschleunigt durch Missbrauch von Antibiotika, wird uns diese wichtige Waffe jedoch zunehmend aus der Hand geschlagen.
Antibiotika-resistente Bakterien haben unterschiedliche Möglichkeiten entwickelt, um diese gegen sie gerichteten Giftstoffe zu entschärfen. Einmal wird das Antibiotikum direkt zerstört, indem es chemisch verändert und damit unwirksam gemacht wird. Auch kann der Angriffspunkt der Wirkung des Antibiotikums umgangen oder durch Modifikation so verändert werden, dass das Antibiotikum daran abgleitet. Die Bakterienzelle kann drittens die giftige Substanz hochselektiv wieder nach außen befördern (Efflux) oder gar nicht erst aufnehmen. Die vierte Möglichkeit zeigt uns sogar unser Körper: Wenn wir etwas gegessen haben, was uns abkömmlich war, übergeben wir uns oder haben Durchfall. Dabei werden die Giftstoffe aus unserem Körper herausgeworfen. Auf der Ebene der Zellen ist der vergleichbare Vorgang die multiple Giftresistenz MDR (multiple drug resistance), bei der eine ganze Gruppe chemisch grob miteinander verwandter Stoffe aus der Zelle herausgepumpt wird. Die Entwicklung von MDR in Tumorzellen ist für viele Misserfolge in der Chemotherapie von Krebserkrankungen verantwortlich und auch für das Auftauchen mancher Antibiotika-resistenter Bakterien. So ist beim Blaueiter-Erreger Pseudomonas aeruginosa, der inbesondere geschwächte Menschen befällt, die Hälfte aller Resistenz-Komplikationen auf das MDR-Phänomen zurückzuführen.
Antibiotika und andere organische Stoffe sind nun unhandlich, wenn die biochemischen Grundlagen von MDR studiert werden sollen. Schwermetalle sind da viel geeigneter. Viele von ihnen wie z. B. Zink, sind in geringen Konzentrationen wichtige Spurenelemente, aber alle sind sie in hohen Dosen giftig (s. folgenden Artikel von Jan Andreesen und Ute Lechner). Schwermetall-Ionen werden meistens durch Bindung oder Efflux entgiftet, so dass Schwermetall-Efflux als biochemisches Modell für Antibiotika-Efflux dienen kann. Auch ist es viel einfacher, mit einem der vielen harmlosen und für uns wichtigen Bakterien zu arbeiten als mit einem pathogenen Organismus.
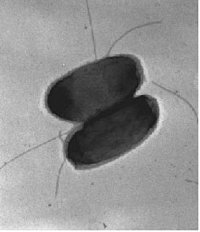
Bild1. Elektronenmikroskopische Aufnahme von zwei Zellen des Bakterium Ralstonia metallidurans
Unser Untersuchungs-Objekt ist daher der harmlose Boden- und Wasser-Bewohner Ralstonia metallidurans (Bild 1), der mit einer Vielzahl von Schwermetall-Resistenzen auch an einem hoch belasteten Standort leben kann. Man findet das Bakterium an jedem Punkt der Erde, wo Schwermetalle anderen Organismen das Leben vergällen. Ein gutes Beispiel ist der Ort, von dem R. metallidurans zuerst isoliert worden ist: Ein Dekantationstank einer Zinkfabrik in Belgien.
Um herauszufinden, wie unser R. metallidurans diese einmalige Anpassungs-Leistung vollbringt, haben wir und andere Arbeitsgruppen ihm durch genetische Manipulationen eine Schwermetall-Resistenz nach der anderen weggenommen. Dabei wurden die resultierenden Mutanten-Stämme zunehmend sensitiver gegen das jeweilige Schwermetall. Wir nennen diese Vorgehensweise „Resistenz-Striptease“. Momentan steht der Zähler bei gut zwei Dutzend Resistenz-Systemen, die auf verschiedene Weisen ein überlappendes Spektrum von Schwermetallen entgiften, meistens durch Efflux.
Die äußerste Abwehrfront, sozusagen der Wintermantel, gegen zu hohe Konzentrationen von Zink, Kobalt und Cadmium ist das Czc-Resistenz-System, über das wir viele Erkenntnisse gewinnen konnten. Czc produziert die CzcCBA-Efflux-Pumpe, die die doppelt positiv geladenen Ionen dieser drei Schwermetalle bei Bedarf aus der Zelle hinausbefördert. Die CzcCBA-Pumpe war der Protopyp für viele später entdeckte Verwandte, von denen die meisten organische Giftstoffe wie Antibiotika durch Efflux entgiften und damit MDR verursachen.
Die besondere Stellung des Czc-Systems bei der Entgiftung von Schwermetallen in Zellen von R. metallidurans beruht auf einer hohen Effizienz der CzcCBA-Pumpe. Diese basiert wiederum auf einer ganz besonderen Anordnung der drei Teile dieses Exportsystems. R. metallidurans ist ein Gram-negatives Bakterium, das als solches über eine geschichtet aufgebaute Zellwand verfügt. Wie alle Lebewesen hat es eine Cytoplasma-Membran (CPM), die das Zellinnere vom Außenmedium abgrenzt. Transport-Proteine darin sorgen spezifisch für den Im- oder Export ausgewählter chemischer Substanzen. Gram-negative Bakterien haben nun eine zweite, äußere Membran zusätzlich zur CPM. Zwischen beiden Membranen liegt der periplasmatische Raum, der die Zellwand des Bakteriums enthält (Bild 2).
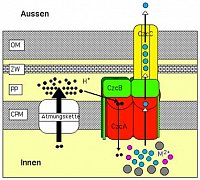
Bild 2. Modell für die Funktion der CzcCBA-Effluxpumpe.
Dieser Proteinkomplex durchspannt die gesamte Zellhülle des Gram-negativen Bakteriums R. metallidurans, die aus der Cytoplasmamembran (CPM), dem Periplasma (PP) mit der darin enthaltenen Murein-Zellwand (ZW) und der äußeren Membran (OM) besteht. CzcA liegt als Dimer in der CPM und nutzt die Batterie-Ladung über der CPM, um überschüssige Schwermetall-Kationen (dicke bunte Kugeln, M2+) aus dem Innenraum der Zelle zu entfernen und zu den periplasmatisch lokalisierten Protein-Teilen zu transportieren. Diese Leistung wird durch einen Protonen-Strom (kleine schwarze Kugeln, H+) als Energiequelle angetrieben, der durch die zelluläre Atmungstätigkeit ermöglicht worden ist. Der tri- oder tetramere CzcB-Adaptor zieht durch „periplasmatisches Küssen“ die vermutete trimere CzcC-Röhre zum CzcA-Motor, so dass dieser die Schwermetall-Kationen wie bei einem Turbolader in die CzcC-Röhre drücken kann. Dieser chemische Konzentrations-Druck sorgt dann für eine problemlose Entsorgung der Schwermetall-Kationen durch Diffusion nach außen.
Export-Pumpen wie CzcCBA überbrücken alle drei Teile der Gram-negativen Zellwand und können ihre Substrate direkt aus dem Zellinneren nach außen schicken. Die CzcA-Untereinheit steckt in der Cytoplasma-Membran und ist der eigentlich Motor der CzcCBA-Pumpe. Für deren Antrieb nutzt die Zelle eine Art Batterie als Energiequelle: Durch die Veratmung von Nahrung werden positiv geladene Wasserstoff-Ionen, Protonen, über die CPM hinweg nach außen geschafft, was ein elektrisches Feld aufbaut. Die Spannung über der CPM ist nicht so hoch wie in unseren Batterien (z. B. 9 V), kann aber immerhin 0.2 V betragen. CzcA lässt nun den Protonen-Strom nach innen zurückfließen und nutzt diese Energie, um überschüssige Zink-, Kobalt- und Cadmium-Kationen ins Periplasma zu schaffen.
Im Gegensatz zu anderen Schwermetall-Effluxpumpen werden die Kationen bei CzcCBA aber nicht ins Periplasma freigesetzt, wo sie Unheil anrichten könnten, sondern durch Einsatz der beiden anderen Untereinheiten des Proteinkomplexes, CzcB und CzcC, weiter nach außen transportiert. Durch die Arbeiten anderer Gruppen, die verwandte Protein-Komplexe studieren, haben wir eine gute Vorstellung, wie dies geschehen könnte. Vom CzcC-verwandten Protein TolC („Tol“ steht für Toluo-Resistenz) wurde sogar die atomare Struktur aufgeklärt (Bild 3a). TolC bildet eine Röhre, die in der äußeren Membran steckt und das ganze Periplasma durchspannen kann. Die Daten über die Form des CzcB-verwandten Proteins AcrA („Acr“ steht für Acriflavin-Resistenz) weisen auf eine Rettungsring-ähnliche Struktur (Bild 3b+c). TolC und AcrA interagieren, der Innendurchmesser von AcrA ist aber zu klein, um die TolC-Röhre aufzunehmen. Das macht auch nichts, da die TolC-Röhre nicht nur mit AcrA, sondern zusätzlich auch noch mit weiteren Export-Systemen zusammenarbeitet. Es ist daher wahrscheinlich, dass TolC nur bei Bedarf mit AcrA in Kontakt tritt, wobei dann beide Proteine ihre „Münder“ aufeinander legen. Wir nennen diesen Vorgang „periplasmisches Küssen“. Interessanterweise hatte die entsprechende menschliche Verhaltensweise ihren Ursprung auch in einer „Transportfunktion“, dem Füttern von Kleinkindern durch die Mutter.
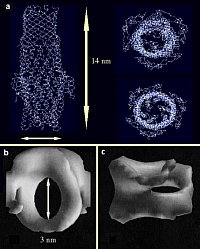
Bild 3. Strukturen des CzcC-verwandten Proteins TolC und des CzcB-verwandten Proteins AcrA
Beim TolC-Protein (a, nach Koronakis et al., 2000, Nature 405, 914-919) bilden drei TolC-Untereinheiten eine 14 nm lange Röhre. Links die Seitenansicht, oben daneben die Ansicht von oben = außen, darunter die von unten. Deutlich sind hier die Irisblenden-artigen Verschlüsse der Röhre zu sehen. AcrA (b von oben, c von der Seite, Avila-Sakar et al., 2001, J. Struct. Biol. 136, 81-88) wurde in der Flüssigschicht-Kristallisation als Rettungsring abgebildet, der beim „periplasmatischen Küssen“ als Adaptor zwischen dem eigentlichen Pumpen-Protein AcrB (mit CzcA verwandt) und der TolC-Röhre dienen könnte.
Bei unseren Schwermetall-Transportern kann das periplasmatische Küssen nun auch promiskuitiv erfolgen. Es wird schon mal eine andere Röhre genutzt, wenn die eigene nicht vorhanden ist. Vor dem Küssen aber werden die zu exportierenden Schwermetalle zunächst, angetrieben durch die Cytoplasmamembran-Batterie, von innen zu periplasmatischen Bindestellen im Pumpenprotein CzcA geschafft. Der CzcB-Adaptor zieht dann die CzcC-Röhre an das CzcA-Protein heran und die Schwermetalle werden in die Röhre hineingedrückt. Die Röhre hat eine direkte Öffnung nach außen und der chemische Konzentrations-Druck, der durch die aktive Einspeisung in die Röhre aufgebaut worden ist, sorgt für eine problemlose Entladung nach außen (Bild 2).
Dieses hypothetische Modell der Funktion der CzcCBA-Pumpe und verwandter Antibiotika-MDR-Pumpen erklärt nicht nur die vorhandenen Daten, es bietet auch Ansatzpunkte für die Entwicklung spezifischer Hemmstoffe dieses Vorgangs. Gelingt dies, werden es uns zukünftige Patienten, die z. B. an Antibiotika-resistenten Blaueiter-Erregern erkrankt sind, vielleicht einmal danken.
Danksagung
Unsere Arbeiten wurden unterstützt durch die Deutsche Forschungsgemeinschaft, dem Land Sachsen-Anhalt und den Fonds der Chemischen Industrie.
